Em nosso dia a dia encontramos as substâncias em três aspectos físicos diferentes, denominados estados que são o sólido, líquido e gasoso.
No estado sólido, os átomos e moléculas de um corpo estão fortemente unidos, com pouca mobilidade. O movimento vibratório ocorre em torno de posições definidas, como se os átomos e moléculas estivessem ligados por molas (a essas posições definidas dá-se o nome de reticulo cristalino). Como consequência, os sólidos possuem forma e volume definido.

No estado líquido, as interações entre átomos e moléculas ainda são suficientemente fortes para dificultar sua separação, o que garante ao líquido um volume definido.
No estado gasoso, a separação entre os átomos e moléculas é grande o suficiente para que se possam movimentar desorganizadamente e com grande liberdade, buscando expandir-se por todo o volume disponível. Por isso é que um cheiro rapidamente se espalha por todo um ambiente.
Fazendo uma substância ganhar ou perder calor, podemos promover as seguintes mudanças em seu estado:

Fusão e solidificação
Fusão: passagem do estado sólido para o líquido.
A medida que fornecemos calor a um sólido, a amplitude das oscilações de seus átomos e moléculas aumenta e, portanto, também sua temperatura.
Atingida uma determinada temperatura, as moléculas passam não mais vibrar em torno de posições definidas, rompendo o reticulo cristalino, começando o processo de fusão.
Com uma pressão constante, a temperatura permanece constante durante esse processo. Isso ocorre porque o calor fornecido implica um aumento da distância média entre os átomos e moléculas, sem aumentar a velocidade de vibração delas – a temperatura. Ela só voltara a subir depois que todo sólido já tiver passado para o estado líquido e mais calor continuar sendo fornecido.
O fato da temperatura permanecer constante durante a mudança de estado dá origem ao dois tipos de calor, sensível e latente.
Solidificação
Passagem do estado líquido para o sólido. À medida que retiramos calor de um líquido reduzimos a energia térmica de seus átomos e moléculas e, com isso, sua temperatura diminui. Atingida uma determinada temperatura, a agitação torna-se devagar o suficiente para permitir a aproximação entre os átomos e moléculas e reconstituir o retículo cristalino. Inicia-se então a solidificação.
Com pressão externa constante, a temperatura permanece constante durante essa reconstituição.
Novamente isso ocorre porque o calor retirado corresponde apenas aquele que mantinha os átomos e moléculas afastados, não o envolvido na agitação delas. A temperatura só voltara a diminuir depois que todo o líquido tiver passado para o estado sólido e mais calor continuar sendo retirado.
Pontos importantes:
- para uma mesma substância e uma mesma pressão externa, a temperatura de fusão é igual a de solidificação;
- não havendo alteração de pressão externa, a temperatura da substância se mantem constante durante a sua fusão ou solidificação (ver tópico calor latente);
- a temperatura de fusão (ou solidificação), na pressão de 1 atm, chama-se ponto de fusão (ou solidificação).
| Ponto de fusão de algumas substancias conhecidas a 1 atm – oC | |
|---|---|
| água | 0 |
| álcool etílico | -114 |
| alumínio | 658 |
| chumbo | 327 |
| cobre | 1083 |
| ferro | 1535 |
| hidrogênio | -259 |
| mercúrio | -39 |
| nitrogênio | -210 |
| oxigênio | -219 |
| tungstênio | 3380 |
Influência da pressão na temperatura de fusão
Quase todas as substâncias aumentam de volume quando passam do estado sólido para o líquido.

Esse aumento de volume é dificultado pela pressão externa. Assim, quanto maior for a pressão externa, maior será a temperatura necessária para o sólido fundir-se.
A tabela abaixo mostra a influência da pressão na temperatura de fusão do enxofre:
| p (atm) | oC |
| 1 | 107 |
| 519 | 135,2 |
| 792 | 140,5 |
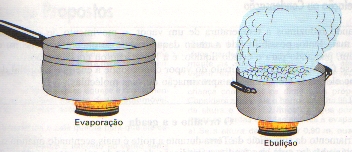
Evaporação
E um tipo de vaporização lenta que ocorre na superfície livre de um líquido. Este fenômeno não requer condições físicas específicas para ocorrer: não há uma temperatura determinada para um líquido evaporar. A água do mar, por exemplo, evapora a 5o C, 20o C ou 60o C. Entretanto, a temperatura influiu na rapidez com que ocorre a evaporação: em temperaturas mais altas, a “velocidade” da evaporação é maior.
Observando o mar ou um tanque contendo água, por alguns minutos, não notamos uma mudança no nível da água, evidência da evaporação, o que mostra que ela lenta.
As moléculas de um líquido possuem, a cada momento, energias térmicas diferentes: algumas têm ela relativamente baixa, outras muito altas e a maioria tem níveis intermediários de energia térmica.
As forças de atração das moléculas dificultam o escape das moléculas situadas na superfície de um líquido. No entanto, as de maior energia térmica conseguem escapar.
Como a temperatura está associada a energia térmica média das moléculas, a saída das mais energéticas reduz a energia térmica média das remanescentes, ou seja, reduz a temperatura do líquido que ainda não evaporou. Assim, a evaporação provoca o resfriamento do líquido.
(Por exemplo, quando molhamos a mão com éter, sentimos esfriar a região molhada, porque as moléculas do éter de maior energia térmica evaporam, sobrando as de energia térmica menor. Assim, a temperatura do éter que resta diminui, provocando uma transferência de calor da mão para ele e a consequente sensação de frio. O processo de evaporação continua, a custa do calor recebido da mão. Também a evaporação da água que escapa pelas porosidades dos potes e das moringas de barro que a mantém fresca, mesmo em dias quentes.
Pontos importantes:
a “velocidade” de evaporação diminui quando aumenta a concentração do vapor líquido nas vizinhanças do líquido. Isso ocorre porque as moléculas do líquido que foram para o ambiente podem retornar para ele: mais moléculas no ambiente implica em maior número de retorno. Por isso, numa mesma temperatura alta de Verão, temos uma sensação térmica de “menos calor” quando o ambiente está seco, pois a velocidade de evaporação do suor é maior. Os aparelhos de ar-condicionado retiram umidade do ar, tornando o ambiente mais seco. Os ventiladores arrastam o vapor de água já formado nas proximidades das pessoas;
- a velocidade de evaporação de um determinado líquido, numa determinada temperatura é tanto maior quanto maior a área da superfície livre. Por isso a roupa estendida no varal seca mais rápido do que se estivesse amontoada;
- mantidas as demais condições, a “velocidade” de evaporação aumenta quando a temperatura aumenta e diminui quando a pressão sobre o líquido aumenta.
Ebulição
É a vaporização intensa e turbulenta que ocorre ao longo de todo a massa líquida, com a formação de bolhas de vapor junto as superfícies aquecidas. Essas bolhas de vapor aumentam de volume à medida que se elevam no líquido, em virtude da redução da pressão.
Ao contrário da evaporação a ebulição só acontece quando é atingida uma determinada temperatura, que depende da pressão exercida sobre o líquido pelo ambiente. Quando aumenta a pressão sobre o líquido, aumenta, também a temperatura que ele deve atingir para entrar em ebulição.
Fornecendo calor a um líquido, a energia térmica de suas moléculas aumenta, ou seja, sua temperatura aumenta. No entanto, quando uma determinada temperatura é atingida, o fornecimento de mais calor ao líquido, ao invés de provocar a elevação da temperatura, faz com que suas moléculas de separem, vencendo a força de união que as mantinha no estado líquido.
Para cada pressão, as substâncias têm uma determinada temperatura de ebulição permanecendo constante a pressão, a temperatura não varia durante toda a ebulição, da mesma forma como acontece com a fusão e solidificação (ver calor latente).
Ponto de ebulição
É a temperatura que ocorre a ebulição de uma substância a pressão de 1 atm. A tabela abaixo fornece os pontos de ebulição de algumas substancias:
| Ponto de ebulição de algumas substancias conhecidas a 1 atm – oC | |
|---|---|
| água | 100 |
| álcool etílico | 78 |
| alumínio | 1800 |
| chumbo | 1620 |
| cobre | 2300 |
| ferro | 3000 |
| hidrogênio | -253 |
| mercúrio | 356 |
| nitrogênio | -196 |
| oxigênio | -183 |
Quando reduzimos a temperatura de um vapor, o movimento de suas moléculas torna-se mais lento, possibilitando a união daquelas que se encontram. Assim elas se aglomeram, passando para o estado líquido: e a liquefação ou condensação.
Mantida a mesma pressão, a temperatura permanece constante enquanto todo o vapor não tiver se transformado em líquido.
Gráfico de aquecimento/ resfriamento da água e mudança de estado

Sublimação e sublimação inversa
Sublimação
É a passagem direta do estado sólido para o gasoso, sem passar pelo estado líquido. Os líquidos em geral estão sempre sublimando, isto é, liberando vapores. Uma prova disso é o fato de cada sólido ter um cheiro característico. Um exemplo tradicional de sublimação é o da bolinha de naftalina: muito lentamente ela vai diminuindo de tamanho, pois perde massa na forma de vapor. Esse processo lento é parecido com o da evaporação de um líquido.
A sublimação inversa é o processo contrário, isto a passagem do estado gasoso para o sólido.
